Взаимодействие муравьиной кислоты с аммиачным раствором гидроксида серебра (реакция серебряного зеркала). В молекуле муравьиной кислоты НСООН имеется альдегидная группа, поэтому открыть ее в растворе можно реакциями, характерными для альдегидов, например реакцией серебряного зеркала.
Готовят в пробирке аммиачный раствор арґентум (Ι)гидроксида. Для этого к 1 - 2 мл 1-процентного раствора арґентум (Ι) нитрата добавляют 1 - 2 капли 10-процентного раствора натрий гидроксида, образовавшийся осадок арґентум (Ι) оксида растворяют, добавляя по каплям 5-процентный раствор аммиака. К полученному прозрачному раствору добавляют 0,5 мл муравьиной кислоты. Пробирку с реакционной смесью нагревают несколько минут в водяной бане (температура воды в бане 60 0 -70 0 С). Металлическое серебро выделяется в виде зеркального налета на стенках пробирки или в виде темного осадка.
НСООН+2Ag[(NH 3) 2 ]ОН → CO 2 + H 2 O+2Ag+ 4NH 3
б) Окисление муравьиной кислоты калий перманганатом. В пробирку помещают примерно 0,5г муравьиной кислоты или ее соли, 0,5 мл 10- процентного раствора сульфатной кислоты и 1мл 5-процентного раствора калий перманганата. Пробирку закрывают пробкой с газоотводной трубкой, конец которой опускают в другую пробирку с 2мл известковой (или баритовой) воды, и нагревают реакционную смесь.
5НСООН+2KMnO 4 +3H 2 SO 4 → 5CO 2 +8H 2 O+K 2 SO 4 +2MnSO 4
в) Разложение муравьиной кислоты при нагревании с концентрированной серной кислотой. (Тяга!) В сухую пробирку вносят 1 мл муравьиной кислоты или 1 г ее соли и 1 мл концентрированной сульфатной кислоты. Пробирку закрывают пробкой с газоотводной трубкой и осторожно нагревают. Муравьиная кислота разлагается с образованием карбон (II) оксида и воды. Карбон (II) оксид поджигают у отверстия газоотводной трубки. Обратите внимание на характер пламени.
После окончания работы пробирку с реакционной смесью необходимо охладить, чтобы прекратить выделение ядовитого угарного газа.
Опыт 12 . Взаимодействие стеариновой и олеиновой кислот со щелочью.
В сухой пробирке растворяют примерно 0,5 г стеарина в диэтиловом эфире (без нагревания) и добавляют 2 капли 1-процентного спиртового раствора фенолфталеина. Затем по каплям приливают 10-процентный раствор натрий гидроксида. Появляющаяся вначале малиновая окраска исчезает при встряхивании.
Напишите уравнение реакции стеариновой кислоты с натрий гидроксидом. (Стеарин представляет собой смесь стеариновой и пальмитиновой кислот.)
С 17 H 35 COOH+NaOH→ С 17 H 35 COONa+H 2 O
натрий стеарат
Повторяют опыт, используя 0,5 мл олеиновой кислоты
С 17 H 33 COOH+NaOH→С 17 H 33 COONa+Н 2 О
олеат натрия
Опыт13 . Отношение олеиновой кислоты к бромной воде и раствору перманганата калия.
а)Реакция олеиновой кислоты с бромной водой В пробирку наливают 2 мл воды и вносят около 0,5 г олеиновой кислоты. Смесь энергично взбалтывают.
б) Окисление олеиновой кислоты калий перманганатом. В пробирку помещают 1 мл 5-процентного раствора калий перманганата, 1мл 10-процентного раствора натрий карбоната и 0,5 мл олеиновой кислоты. Смесь энергично перемешивают. Отмечают изменения, происходящие с реакционной смесью.

Опыт 14 . Возгонка бензойной кислоты.
Возгонку малых количеств бензойной кислоты ведут в фарфоровой чашке, закрытой широким концом конической воронки (см. рис. 1), диаметр которой несколько меньше диаметра чашки.
Носик воронки закрепляют в лапке штатива и плотно закрывают ватой, а для того, чтобы возгон не попадал обратно в чашку, ее прикрывают круглым листком фильтровальной бумаги с несколькими отверстиями в нем. Фарфоровую чашку с мелкими кристаллами бензойной кислоты (t пл =122,4 0 С; возгоняется ниже t пл) осторожно медленно нагревают на небольшом пламенигазовой горелки (на асбестовой сетке). Можно охладить верхнюю воронку, прикладывая смоченный холодной водой кусочек фильтровальной бумаги. После прекращения возгонки (через 15 - 20 мин) сублимат осторожнопереносят шпателем в склянку.

Примечание. Для проведения работы, бензойную кислоту можно загрязнитьпеском.
Пробирку, в которой образовалась эмульсия, закрывают пробкой с обратным холодильником, нагревают в водяной бане до начинающегося кипения и встряхивают. Увеличивается ли растворимость масла при нагревании?
Опыт повторяют, но вместо подсолнечного масла в пробирки с органическими растворителями вносят небольшое количество животного жира (свиного, говяжьего или бараньего сала),
б) Определение степени непредельности жира реакцией с бромной водой. (Тяга!) В пробирку наливают 0.5 мл подсолнечного масла и 3 мл бромной воды. Содержимое пробирки энергично взбалтывают. Что происходит с бромной водой?
в) Взаимодействие растительного масла с водным раствором калий перманганата (реакция Е. Е. Вагнера). В пробирку наливают примерно 0,5 мл подсолнечного масла, 1 мл 10-процентного раствора карбоната натрия и 1 мл 2-процентного раствора калий перманганата. Энергично встряхивают содержимое пробирки. Фиолетовая окраска калий перманганата исчезает.
Обесцвечивание бромной воды и реакция с водным раствором калий перманганата - качественные реакции на присутствие кратной связи (ненасыщенность) в молекуле органического вещества.
г) Омыление жира спиртовым раствором натрий гидроксида В коническую колбу емкостью 50 - 100 мл помещают 1.5 - 2 г твердого жира и приливают 6 мл 15-процентного спиртового раствора натрий гидроксида. Колбу закрывают пробкой с воздушным холодильником, перемешивают реакционную смесь и нагревают колбу в водяной бане при встряхивании в течение 10 – 12 мин (температура воды в бане около 80 0 С). Для определения конца реакции несколько капель гидролизата выливают в 2-3 мл горячей дистиллированной воды: если гидролизат растворяется полностью, без выделения капель жира, то реакцию можно считать законченной. После окончания омыления из гидролизата высаливают мыло добавлением 6 - 7 мл горячего насыщенного раствора натрий хлорида. Выделяющееся мыло всплывает, образуя на поверхности раствора слой. После отстаивания смесь охлаждают холодной водой, затвердевшее мыло отделяют.
Химизм процесса на примере тристеарина:

Опыт 17. Сравнение свойств мыла и синтетических моющих средств
а) Отношение к фенолфталеину. Налейте в одну пробирку 2-3 мл 1-процентного раствора хозяйственного мыла, в другую - столько же 1- процентного раствора синтетического стирального порошка. Добавьте в обе пробирки по 2-3 капли раствора фенолфталеина. Можно ли использовать данные моющие средства для стирки тканей, чувствительных к щелочам?
б) Отношение к кислотам. К растворам мыла и стирального порошка в пробирках добавьте насколько капель 10-процентного раствора кислоты (хлоридной или сульфатной). Образуется ли пена при встряхивании? Сохраняются ли моющие свойства исследуемых средств в кислой среде?
C 17 H 35 COONa+HCl→C 17 H 35 COOH↓+NaCl
в) Отношение к кальций хлориду. К растворам мыла и стирального порошка в пробирках добавляют по 0,5 мл 10-процентного раствора кальций хлорида. Встряхивают содержимое пробирок. Образуется ли при этом пена? Можно ли использовать данные средства для стирки в жесткой воде?
C 17 H 35 COONa+CaCl 2 →Ca(C 17 H 35 COO) 2 ↓+2NaCl
Опыт 18 . Взаимодействие глюкозы с аммиачным раствором аргентум (Ι) оксида (реакция серебряного зеркала).
В пробирку наливают 0.5 мл 1-процентного раствора аргентум(Ι) нитрата, 1 мл 10-процентного раствора натрий гидроксида и приливают по каплям 5-процентный раствор аммиака до растворения образовавшегося осадка аргентум (Ι) гидроксида. Затем добавляют 1 мл 1-процентного раствора глюкозы и нагревают содержимое пробирки 5 - 10 мин в водяной бане при 70 0 – 80 0 С. Металлическое серебро выделяется на стенках пробирки в виде зеркального налета. Во время нагревания пробирки нельзя встряхивать, иначе металлическое серебро выделится не на стенках пробирок, а в виде темного осадка. Чтобы получить хорошее зеркало, в пробирках предварительно кипятят 10-процентный раствор натрий гидроксида, затем их споласкивают дистиллированной водой.

В пробирку наливают 3 мл 1-процентного раствора сахарозы и прибавляют 1 мл 10-процентного раствора серной кислоты. Полученный раствор кипятят в течение 5 мин, затем охлаждают и нейтрализуют сухим гидрокарбонатом натрия, добавляя его небольшими порциями при перемешивании (осторожно, жидкость вспенивается от выделяющегося оксида углерода (IY)). После нейтрализации (когда прекратится выделение СО 2) приливают равный объем реактива Фелинга и нагревают верхнюю часть жидкости до начинающегося кипения.
Изменяется ли окраска реакционной смеси?
В другой пробирке нагревают смесь 1,5 мл 1-процентного раствора сахарозы с равным объемом реактива Фелинга. Сравнивают результаты опыта – реакцию сахарозы с реактивом Фелинга до гидролиза и после гидролиза.
С 12 Н 22 О 11 + Н 2 О С 6 Н 12 О 6 + С 6 Н 12 О 6
глюкоза фруктоза
Примечание. В условиях школьной лаборатории реактив Фелинга можно заменить купрум (ΙΙ)гидроксидом.
Опыт 20. Гидролиз целлюлозы.
В сухую коническую колбу емкостью 50 – 100 мл помещают немного очень мелко нарезанных кусочков фильтровальной бумаги (целлюлозы) и смачивают их концентрированной сульфатной кислотой. Тщательно перемешивают содержимое колбы стеклянной палочкой до полного разрушения бумаги и образования бесцветного вязкого раствора. После этого к нему добавляют небольшими порциями при перемешивании 15 – 20 мл воды (осторожно!), колбу соединяют с воздушным обратным холодильником и кипятят реакционную смесь 20 – 30 мин, перемешивая ее периодически. После окончания гидролиза отливают 2 – 3 мл жидкости, нейтрализуют ее сухим натрий карбонатом, добавляя его небольшими порциями (жидкость вспенивается), и обнаруживают присутствие восстанавливающих сахаров реакцией с реактивом Фелинга или купрум (ΙΙ) гидроксидом.
(C 6 H 10 O 5)n+nH 2 O→nC 6 H 12 O 6
Целлюлоза глюкоза
Опыт 21. Взаимодействие глюкозы с купрум (ΙΙ) гидроксидом.
а)
В пробирку помещают 2 мл 1-процентного
раствора глюкозы и 1 мл 10-процентного
натрий гидроксида. К полученной смеси
добавляют 1 - 2 капли 5-процентного раствора
купрум (ΙΙ) сульфата и встряхивают
содержимое пробирки. Образующийся
вначале голубоватый осадок купрум (ІІ)
гидроксида мгновенно растворяется,
получается синий прозрачный раствор
купрум (ΙΙ) сахарата.
Химизм процесса
(упрощенно): -
 б)
Содержимое пробирки нагревают над
пламенем горелки, держа пробирку наклонно
так, чтобы нагревалась только верхняя
часть раствора, а нижняя оставалась без
нагрева (для контроля). При осторожном
нагревании до кипения, нагретая часть
синего раствора окрашивается в
оранжево-желтый цвет вследствие
образования купрум (Ι) гидроксида. При
более продолжительном нагревании может
образоваться осадок купрум (Ι)оксида.
б)
Содержимое пробирки нагревают над
пламенем горелки, держа пробирку наклонно
так, чтобы нагревалась только верхняя
часть раствора, а нижняя оставалась без
нагрева (для контроля). При осторожном
нагревании до кипения, нагретая часть
синего раствора окрашивается в
оранжево-желтый цвет вследствие
образования купрум (Ι) гидроксида. При
более продолжительном нагревании может
образоваться осадок купрум (Ι)оксида.
 Опыт 22.
Взаимодействие
сахарозы с гидроксидами металлов.
а)
Реакция с
купрум (ΙΙ) гидроксидом) в щелочной
среде.
В
пробирке смешивают 1,5 мл 1-процентного
раствора сахарозы и 1,5 мл 10-процентного
раствора натрий гидроксида. Затем по
каплям добавляют 5-процентный раствор
купрум (ΙΙ) сульфата. Образующийся
вначале бледно-голубой осадок купрум
(ΙΙ) гидроксида при встряхивании
растворяется, раствор приобретает
сине-фиолетовую окраску вследствие
образования комплексного купрум (ΙΙ)
сахарата.
Опыт 22.
Взаимодействие
сахарозы с гидроксидами металлов.
а)
Реакция с
купрум (ΙΙ) гидроксидом) в щелочной
среде.
В
пробирке смешивают 1,5 мл 1-процентного
раствора сахарозы и 1,5 мл 10-процентного
раствора натрий гидроксида. Затем по
каплям добавляют 5-процентный раствор
купрум (ΙΙ) сульфата. Образующийся
вначале бледно-голубой осадок купрум
(ΙΙ) гидроксида при встряхивании
растворяется, раствор приобретает
сине-фиолетовую окраску вследствие
образования комплексного купрум (ΙΙ)
сахарата.
б) Получение кальций сахарата. В небольшой стакан (25 - 50 мл) наливают 5 - 7 мл 20-процентного раствора сахарозы и по каплям при перемешивании добавляют свежеприготовленное известковое молоко. Кальций гидроксид растворяется в растворе сахарозы. Способность сахарозы давать растворимые сахараты кальция используется в промышленности для очистки сахара при выделении его из сахарной свеклы. в) Специфические цветные реакции. В две пробирки наливают по 2 - 5 мл 10-процентного раствора сахарозы и по 1 мл 5-процентного раствора натрий гидроксида. Затем в одну пробирку добавляют несколько капель 5- процентного раствора кобальт (ΙΙ) сульфата, в другую - несколько капель 5- процентного раствора никель (ΙΙ) сульфата. В пробирке с солью кобальта появляется фиолетовое окрашивание, а с солью никеля - зеленое, Опыт2З. Взаимодействие крахмала с йодом. В пробирку наливают 1 мл 1 -процентного раствора крахмального клейстера и затем добавляют несколько капель сильно разбавленного водой йода в калий йодиде. Содержимое пробирки окрашивается в синий цвет. Полученную темно-синюю жидкость нагревают до кипения. Окраска при этом исчезает, но при охлаждении появляется вновь. Крахмал является неоднородным соединением. Он представляет собой смесь двух полисахаридов - амилозы (20%) и амилопектина (80%). Амилоза растворима в теплой воде и дает с йодом синее окрашивание. Амилоза состоит из почти неразветвленных цепей глюкозных остатков, обладающих структурой винта или спирали (примерно 6 глюкозных остатков в одном винте). Внутри спирали остается свободный канал диаметром около 5 мк, в который внедряются молекулы йода, образуя окрашенные комплексы. При нагревании эти комплексы разрушаются. Амилопектин в теплой воде не растворим, набухает в ней, образуя крахмальный клейстер. В его состав входят разветвленные цепи глюкозных остатков. Амилопектин с йодом дает красновато-фиолетовое окрашивание, обусловленное адсорбцией молекул йода на поверхности боковых цепей. Опыт 24. Гидролиз крахмала. а) Кислотный гидролиз крахмала. В коническую колбу емкостью 50 мл наливают 20 - 25 мл 1-процентного крахмального клейстера и 3 - 5 мл 10-процентного раствора сульфатной кислоты. В 7 - 8 пробирок наливают по 1 мл очень разбавленного раствора йода в калий йодиде (светло-желтого цвета), пробирки ставят в штатив. В первую пробирку вносят 1 – 3 капли подготовленного для опыта раствора крахмала. Отмечают образовавшуюся окраску. Затем колбу нагревают на асбестовой сетке небольшим пламенем горелки. Через 30 секунд после начала кипения отбирают пипеткой вторую пробу раствора, которую вносят во вторую пробирку с раствором йода, после встряхивания отмечают цвет раствора. В дальнейшем отбирают пробы раствора через каждые 30 секунд и вносят их в последующие пробирки с раствором йода. Отмечают постепенное изменение окраски растворов при реакции с йодом. Изменение окраски происходит в следующем порядке, см. табл.
После того как реакционная смесь перестанет давать окраску с йодом, смесь кипятят еще 2 - З мин после чего ее охлаждают и нейтрализуют 10 – процентным раствором натрий гидроксида, добавляя его по каплям до щелочной реакции среды (появления розовой окраски на фенолфталеиновой индикаторной бумаге). Часть щелочного раствора переливают в пробирку, смешивают с равным объемом реактива Фелинга или свежеприготовленной суспензией купрум (ΙΙ) гидроксида и нагревают верхнюю часть жидкости до начинающегося кипения.
(
Растворимый
Декстрины
С 6 Н 10 О 5)n (С 6 Н 10 О 5)x (С 6 Н 10 О 5)y
мальтоза
n/2 С 12 Н 22 O 11 nС 6 Н 12 О 6
б) Ферментативный гидролиз крахмала.
Хорошо разжевывают маленький кусочек черного хлеба и помещают его в пробирку. Вносят в нее несколько капель 5 - процентного раствора купрум (ΙΙ) сульфата и 05 - 1 мл 10-процентного раствора натрий гидроксида. Пробирку с содержимым нагревают. 3. Техника и методика демонстрационных опытов по получению и изучению свойств нитрогенсодержащих органических веществ.
Оборудование: химические стаканы, стеклянная палочка, пробирки, колба Вюрца, капельная воронка, химический стакан, стеклянные газоотводные трубки, соединительные резиновые трубки, лучинка.
Реактивы: анилин, метиламин, растворы лакмуса и фенолфталеина, концентрированная хлоридная кислота, раствор натрий гидроксида(10 %), раствор хлорной извести, концентрированная сульфатная кислота, концентрированная нитратная кислота, яичный белок, раствор медного купороса, плюмбум (ΙΙ) ацетат, раствор фенола, формалин.
Опыт 1 . Получение метиламина. В колбу Вюрца объемом 100 - 150 мл внести 5-7 г метиламин хлорида и закрыть пробкою со вставленной в нее капельной воронкой. Газоотводную трубку соединить резиновой трубкой со стеклянным наконечником и опустить в стакан с водой. Из воронки каплями добавлять раствор калий гидроксида (50 %). Смесь в колбе осторожно нагреть. Происходит разложение соли и выделение метиламина, который легко распознать по характерному запаху, который напоминает запах аммиака. Метиламин собирается на дне стакана под слоем воды: + Cl - +KOH → H 3 C – NH 2 +KCl+H 2 O
Опыт 2. Горение метиламина. Метиламин на воздухе горит бесцветным пламенем. К отверстию газоотводной трубки прибора, описанного в предыдущем опыте, поднести горящую лучинку и наблюдать горение метиламина: 4H 3 C – NH 2 +9O 2 → 4CO 2 +10 H 2 O+2N 2
Опыт 3. Отношение метиламина к индикаторам. Полученный метиламин пропустить в пробирку, заполненную водой и одним из индикаторов. Лакмус синеет, а фенолфталеин становится малиновым: H 3 C – NH 2 +H – OH → OH Это свидетельствует об основных свойствах метиламина.
Опыт 4. Образование солей метиламином. а) К отверстию пробирки, из которой выделяется газообразный метиламин, подносят стеклянную палочку, смоченную концентрированной хлоридной кислотой. Палочка окутывается туманом.
H 3 C – NH 2 +HCl → + Cl -
б) В две пробирки наливают по 1 - 2 мл: в одну - З-процентный раствор ферум (III) хлорида, в другую 5-процентный раствор купрум (ΙΙ)сульфата. В каждую пробирку пропускают газообразный метиламин. В пробирке с раствором ферум (III) хлорида выпадает бурый осадок, а в пробирке с раствором купрум (ΙΙ) сульфата образующийся вначале осадок голубого цвета растворяется с образованием комплексной соли, окрашенной в ярко-синий цвет. Химизм процессов:
3 + OH - +FeCl 3 → Fe(OH)↓+3 + Cl -
2 + OH - +CuSO 4 →Cu(OH) 2 ↓+ + SO 4 -
4 + OH - + Cu(OH) 2 →(OH) 2 +4H 2 O
Опыт 5 . Взаимодействие анилина с хлоридной кислотой. В пробирку с 5 мл анилина прилить столько же концентрированной хлоридной кислоты. Пробирку охладить в холодной воде. Выпадает осадок анилин гидроген хлорида. В пробирку с твердым гидроген хлоридным анилином прилить немного воды. После перемешивания, анилин гидроген хлорида растворяется в воде.
C 6 H 5 – NH 2 + HCl → Cl - Опыт 6. Взаимодействие анилина с бромной водой. К 5 мл воды прилить 2 -З капли анилина и смесь сильно встряхнуть. К полученной эмульсии по каплям прибавить бромную воду. Смесь обесцвечивается, и выпадает белый осадок триброманилина.

Опыт 7. Окрашивание ткани анилиновым красителем. Крашение шерсти и шелка кислотными красителями. Растворяют 0,1 г метилового оранжевого в 50 мл воды. Раствор разливают в 2 стакана. В один из них добавляют 5 мл 4н раствора сульфатной кислоты. Затем в оба стакана опускают кусочки белой шерстяной (или шелковой) ткани. Растворы с тканью кипятят 5 мин. Затем ткань вынимают, промывают водой, выжимают и высушивают на воздухе, развесив на стеклянных палочках. Обратите внимание на различие в интенсивности окраски кусочков ткани. Как влияет кислотность среды на процесс окраски ткани?
Опыт 8 . Доказательство наличия функциональных групп в растворах аминокислот. а) Обнаружение карбоксильной группы. К 1 мл 0,2-процентного раствора натрий гидроксида, окрашенного фенолфталеином в розовый цвет, прибавляют по каплям 1 - процентный раствор аминоацетатной кислоты (глицина) до обесцвечивания смеси HOOC – CH 2 – NH 2 + NaOH → NaOOC – CH 2 – NH 2 + H 2 O б) Обнаружение аминогруппы. К 1 мл 0,2-процентного - раствора хлоридной кислоты, окрашенного индикатором конго в синий цвет (кислая среда), прибавляют по каплям 1- процентный раствор глицина до изменения окраски смеси на розовую (нейтральная среда):
HOOC – CH 2 – NH 2 +HCl → Cl -
Опыт 9 . Действие аминокислот на индикаторы. В пробирку внести 0,3 г глицина и добавить 3 мл воды. Раствор разлить на три пробирки. В первую пробирку добавить 1 - 2 капли метилоранжа, во вторую - столько же раствора фенолфталеина, в третью - раствор лакмуса. Окраска индикаторов не меняется, что объясняется наличием в молекуле глицина кислотной (-СООН) и основной (-NH 2) групп, которые взаимно нейтрализуются.
Опыт 10. Осаждение белков. а) В две пробирки с раствором белка добавить по каплям растворы медного купороса и плюмбум (ΙΙ) ацетата. Образуются хлопьевидные осадки, растворяющиеся в избытке растворов солей.
б) В две пробирки с раствором белка добавляют равные объемы растворов фенола и формалина. Наблюдать осаждение белка. в) Нагреть раствор белка в пламени горелки. Наблюдать помутнение раствора, что обусловлено разрушением гидратных оболочек возле частичек белка и увеличение их.
Опыт 11 . Цветные реакции белков. а) Ксантопротеиновая реакция. К 1 мл белка добавить 5- 6 капель концентрированной нитратной кислоты. При нагревании раствор и осадок окрашивается в ярко-желтый цвет. б) Биуретовая реакция. К 1 - 2 мл раствора белка добавить столько же разбавленного раствора медного купороса. Жидкость окрашивается в красно-фиолетовый цвет. Биуретовая реакция дает возможность выявить в молекуле белка пептидную связь. Ксантопротеиновая реакция происходит только в том случае, если в молекулах белка содержатся остатки ароматических аминокислот (фенилаланин, тирозин, триптофан).
Опыт 12. Реакции с карбамидом. а) Растворимость мочевины в воде. В пробирку помещают 0,5 г кристаллической мочевины и постепенно добавляют воду до полного растворения мочевины. По капле полученного раствора наносят на красную и синюю лакмусовую бумагу. Какую реакцию (кислую, нейтральную или щелочную) имеет водный раствор мочевины? В водном растворе мочевина находится в виде двух таутомерных форм:

б) Гидролиз мочевины. Как и все амиды кислот, мочевина легко гидролизуется в кислой и в щелочной средах. Наливают в пробирку 1 мл 20-процентного раствора мочевины и добавляют 2 мл прозрачной баритовой воды. Раствор кипятят до появления в пробирке осадка барий карбоната. Выделяющийся из пробирки аммиак обнаруживают по посинению влажной лакмусовой бумаги.
H 2 N – C – NH 2 +2H 2 O→2NH 3 +[ HO – C – OH]→CO 2
→Н 2 О
Ba(OH) 2 + CO 2 →BaCO 3 ↓+ H 2 O
в) Образование биурета. В сухой пробирке нагревают 0,2 г мочевины. Сначала мочевина плавится (при 133 С), затем при дальнейшем нагревании разлагается с выделением аммиака. Аммиак обнаруживают по запаху (осторожно!) и по посинению влажной красной лакмусовой бумаги, поднесенной к отверстию пробирки. Через некоторое время расплав в пробирке затвердевает, несмотря на продолжающееся нагревание:

Пробирку охлаждают, добавляют в нее 1 -2 мл воды и при слабом нагревании растворяют биурет. В расплаве, кроме биурета, содержится некоторое количество труднорастворимой в воде циануровой кислоты, поэтому раствор получается мутным. Когда осадок отстоится, сливают с него раствор биурета в другую пробирку, добавляют несколько капель 10-процентного раствора натрий гидроксида (при этом раствор становится прозрачным) и 1-2 капли 1- процентного раствора купрум (ΙΙ)сульфата. Раствор окрашивается в розово-фиолетовый цвет. Избыток купрум (ΙΙ) сульфата маскирует характерное окрашивание, вызывая посинение раствора, поэтому его следует избегать.
Опыт 13. Функциональный анализ органических веществ. 1. Качественный элементарный анализ органических соединений. Наиболее распространенными элементами в органических соединениях, кроме Карбона, являются Гидроген, Оксиген, Нитроген, галогены, Сульфур, Фосфор. Обычные методы качественного анализа неприменимы для анализа органических соединений. Для обнаружения Карбона, Нитрогена, Сульфура и других элементов органическое вещество разрушают путем сплавления с натрием, при этом исследуемые элементы переходят в неорганические соединения. Например, Карбон переходит в карбон (IУ) оксид, Гидроген - в воду, Нитроген - в натрий цианид, Сульфур - в натрий сульфид, галогены - в натрий галогениды. Далее открывают элементы обычными методами аналитической химии.
1. Обнаружение Карбона и Гидрогена окислением вещества купрум(II) оксидом.

Прибор для одновременного обнаружения Карбона и Гидрогена в органическом веществе:
1 – сухая пробирка со смесью сахарозы и купрум (II) оксидом;
2 – пробирка с известковой водой;
4 – безводный купрум (ΙΙ) сульфат.
Наиболее общим, универсальным методом обнаружения в органическом веществе. углерода и одновременно с ним водорода является окисление купрум (II) оксидом. При этом Карбон превращается в карбон (IУ) оксид, а Гидроген - в воду. В сухую пробирку с газоотводной трубкой (рис. 2) помещают 0,2 - 0,3 г сахарозы и 1 - 2 г порошка купрум (II) оксида. Содержимое пробирки тщательно перемешивают, сверху смесь засыпают слоем купрум (II) оксида - примерно 1 г. В верхнюю часть пробирки (под пробку) помещают маленький кусочек ваты, на которую насыпают немного безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой и закрепляют ее в лапке штатива с небольшим наклоном в сторону пробки. Свободный конец газоотводной трубки опускаю в пробирку с известковой (или баритовой) водой так, чтобы, трубка почти касалась поверхности жидкости. Сначала нагревают всю пробирку, затем сильно нагревают ту часть, где находится реакционная смесь. Отметьте, что происходит с известковой водой. Почему изменяется цвет купрум (ΙΙ) сульфата?
Химизм процессов: C 12 H 22 O 11 +24CuO→12CO 2 +11H 2 O+24Cu
Ca(OH) 2 +CO 2 →CaCO 3 ↓+H 2 O
CuSO 4 +5H 2 O→CuSO 4 ∙ 5H 2 O
2. Проба Бейльштей на на галогены. При прокаливании органического вещества с купрум (II) оксидом происходит его окисление. Карбон превращается в карбон(ІУ) оксид, Гидроген - в воду, а галогены (кроме флуора) образуют с Купрумом летучие галогениды, которые окрашивают пламя в ярко-зеленый цвет. Реакция очень чувствительна. Однако следует иметь в виду, что и некоторые другие соли купрума, например цианиды, образующиеся при прокаливании нитргенсодержащих органических соединений (мочевины, производных пиридина, хинолина и др.), также окрашивают пламя. Медную проволоку держат за пробку и прокаливают другой конец ее (петлю) в пламени горелки до прекращения окрашивания пламени и образования на поверхности черного налета купрум(II) оксида. Остывшую петлю смачивают хлороформом, налитым в пробирку, и снова вводят в пламя горелки. Сначала пламя становится светящимся (сгорает Карбон), затем появляется интенсивное зеленое окрашивание. 2Cu+O 2 →2CuO
2CH – Cl 3 +5CuO→CuCl 2 +4CuCl+2CO 2 +H 2 O
Следует сделать контрольный опыт, используя вместо хлороформа вещество, не содержащее галоген (бензол, воду, спирт). Для очистки проволоку смачивают хлоридной кислотой и прокаливают.
II. Открытие функциональных групп. На основании предварительного анализа (физические свойства, элементный анализ) можно ориентировочно определить класс, к которому принадлежит данное исследуемое вещество. Эти предположения подтверждают качественными реакциями на функциональные группы.
1. Качественные реакции на кратные карбон - карбоновые связи. а) присоединение брома. Углеводороды, содержащие двойные и тройные связи, легко присоединяют бром:

К раствору 0,1 г (или 0,1 мл) вещества в 2 - З мл четыреххлористого карбона или хлороформа добавляют по каплям при встряхивании 5-процентный раствор брома в том же растворителе. Мгновенное исчезновение окраски брома свидетельствует о наличии кратной связи в веществе. Но раствор брома также обесцвечивается соединениями, содержащими подвижный Гидроген (фенолы, ароматические амины, третичные углеводороды). Однако при этом происходит реакция замещения с выделением гидроген бромида, присутствие которого легко обнаружить с помощью влажной бумажки синего лакмуса или конго. б) Проба с калий перманганатом . В слабощелочной среде при действии калий перманганата происходит окисление вещества с разрывом кратной связи, раствор при этом обесцвечивается, и образуется хлопьевидный осадок MnO 2 - манган (IУ) оксид. К 0,1 г (или 0,1 мл) вещества, растворенного в воде или ацетоне, добавляют по каплям при встряхивании 1-процентный раствор калий перманганата. Происходит быстрое исчезновение малиново-фиолетовой окраски, и появляется бурый осадок MnO 2 . Однако калий перманганат окисляет вещества других классов: альдегиды, многоатомные спирты, ароматические амины. При этом также обесцвечиваются растворы, но окисление протекает большей частью значительно медленнее.
2. Обнаружение ароматических систем. Ароматические соединения в отличие от алифатических соединений способны легко вступать в реакции замещения, часто образуя окрашенные соединения. Обычно для этого используют реакцию нитрования и алкилирования. Нитрование ароматических соединений. (‘Осторожно! Тяга!,) Нитрование проводят азотной кислотой или нитрующей смесью:
R – H + HNO 3 → RNO 2 + H 2 O
В пробирку помещают 0,1 г (или 0,1 мл) вещества и при непрерывном встряхивании постепенно прибавляют З мл нитрующей смеси (1 часть концентрированной нитратной кислоты и 1 часть концентрированной сульфатной кислоты). Пробирку закрывают пробкой с длинной стеклянной трубкой, которая служит обратным холодильником, и нагревают на водяной бане 5 мин при 50 0 С. Смесь выливают в стакан с 10 г измельченного льда. Если при этом выпадает твердый продукт или масло, нерастворимые в воде и отличающиеся от исходного вещества, то можно предположить присутствие ароматической системы. 3.Качественные реакции спиртов. При анализе на спирты используют реакции замещения как подвижного гидрогена в гидроксильной группе так и всей гидроксильной группы. а) Реакция с металлическим натрием. Спирты легко реагируют с натрием, образуя при этом алкоголяты, растворимые в спирте:
2 R – OH + 2 Na → 2 RONa + H 2
В пробирку помещают 0,2 - 0,3 мл безводного исследуемого вещества и осторожно добавляют маленький кусочек металлического натрия величиной с просяное зерно. Выделение газа при растворении натрия указывает на присутствие активного водорода. (Однако эту реакцию также могут давать кислоты и СН-кислоты.) б) Реакция с купрум (II) гидроксидом. В двух-, трех- и многоатомных спиртах в отличие от одноатомных спиртов растворяется свежеприготовленный купрум (II) гидроксид с образованием темно- синего раствора комплексных солей соответствующих производных (гликолятов, глицератов). В пробирку наливают несколько капель (0,3 - 0,5 мл) 3-процентного раствора купрум (ΙΙ) сульфата, а затем 1 мл 10-процентного раствора натрий гидроксида. Выпадает студенистый голубой осадок купрум (ΙΙ) гидроксида. Растворение осадка при добавлении 0,1 г исследуемого вещества и изменение цвета раствора до темно-синего подтверждают присутствие многоатомного спирта с гидроксильными группами, расположенными у соседних атомов карбона.
4.
Качественные реакции фенолов.
а)
Реакция с ферум (III) хлоридом.
Фенолы
дают с ферум (III) хлоридом интенсивно
окрашенные комплексные соли. Обычно
появляется глубокая синяя или фиолетовая
окраска. Некоторые фенолы дают зеленое
или красное окрашивание, оно ярче
проявляется в воде и хлороформе и хуже
в спирте.
В пробирку помещают несколько
кристаллов (или 1 - 2 капли) исследуемого
вещества в 2 мл воды или хлороформа,
затем добавляют при встряхивании 1 - 2
капли 3 процентного раствора ферум (III)
хлорида. В присутствии фенола появляется
интенсивная фиолетовая или синяя
окраска. Алифатические фенолы с ферум
(ΙΙΙ) хлоридом в спирте дают более яркую
окраску, чем в воде, а для фенолов
характерно кроваво-красное окрашивание.
б) Реакция с бромной водой.
Фенолы
со свободными орто-
и пара
-положениями
в бензольном ядре легко обесцвечивают
бромную воду, при этом получается осадок
2,4,6- трибромфенола

Небольшое количество исследуемого вещества встряхивают с 1 мл воды, затем прибавляют по каплям бромную воду. Происходит обесцвечивание раствора и вьпадение белого осадка.
5. Качественные реакции альдегидов. В отличие от кетонов все альдегиды легко окисляются. На этом свойстве основано открытие альдегидов, но не кетонов. а) Реакция серебряного зеркала. Все альдегиды легко восстанавливают аммиачный раствор аргентум (Ι) оксида. Кетоны не дают этой реакции:
В хорошо вымытой пробирке смешивают 1 мл раствора нитрата серебра с 1 мл разбавленного раствора натрий гидроксида. Выпавший осадок аргентум (Ι) гидроксида растворяют при добавлении 25-процентного раствора аммиака. К полученному раствору прибавляют несколько капель спиртового раствора анализируемого вещества. Пробирку помещают на водяную баню и нагревают до 50 0 - 60 0 С. Если на стенках пробирки выделяется блестящий налет металлического серебра, то это свидетельствует о наличии альдегидной группы в образце. Следует отметить, что эту реакцию могут давать также и другие легко окисляющиеся, соединения: многоатомные фенолы, дикетоны, некоторые ароматические амины. б) Реакция с фелинговой жидкостью. Альдегиды жирного ряда способны восстанавливать двухвалентный купрум до одновалентного:
 Пробирку
с 0,05 г вещества и З мл фелинговой жидкости
нагревают З -- 5 минут на кипящей водяной
бане. Появление желтого или красного
осадка купрум (I)
оксида подтверждает наличие альдегидной
группы.
б. Качественные
реакции кислот.
а)
Определение кислотности.
Водно-спиртовые
растворы карбоновых кислот
показывают
кислую реакцию на лакмус, конго или
универсальный индикатор.
Каплю
водно-спиртового раствора исследуемого
вещества наносят на синюю влажную
бумажку лакмуса, конго или универсального
индикатора. При наличии кислоты индикатор
меняет свой цвет: лакмус становится
розовым, конго-синим, а универсальный
индикатор в зависимости от кислотности
- от желтого до оранжевого.
Следует
иметь в виду, чтосульфокислоты,
нитрофенолы и
некоторые
другие соединения с подвижным «кислым»
гидрогеном, не содержащие карбоксильной
группы, могут давать также изменение
цвета индикатора.
б) Реакция с натрий
гидрокарбонатом.
При взаимодействии
карбоновых кислот с натрий гидрокарбонатом
происходит выделение карбон(IY)
оксида:
В пробирку наливают 1 - 1,5 мл
насыщенного раствора натрий гидрокарбоната
и добавляют 0,1 - 0,2 мл водно-спиртового
раствора исследуемого вещества. Выделение
пузырьков карбон(IY)
оксида указывает на наличие кислоты.
Пробирку
с 0,05 г вещества и З мл фелинговой жидкости
нагревают З -- 5 минут на кипящей водяной
бане. Появление желтого или красного
осадка купрум (I)
оксида подтверждает наличие альдегидной
группы.
б. Качественные
реакции кислот.
а)
Определение кислотности.
Водно-спиртовые
растворы карбоновых кислот
показывают
кислую реакцию на лакмус, конго или
универсальный индикатор.
Каплю
водно-спиртового раствора исследуемого
вещества наносят на синюю влажную
бумажку лакмуса, конго или универсального
индикатора. При наличии кислоты индикатор
меняет свой цвет: лакмус становится
розовым, конго-синим, а универсальный
индикатор в зависимости от кислотности
- от желтого до оранжевого.
Следует
иметь в виду, чтосульфокислоты,
нитрофенолы и
некоторые
другие соединения с подвижным «кислым»
гидрогеном, не содержащие карбоксильной
группы, могут давать также изменение
цвета индикатора.
б) Реакция с натрий
гидрокарбонатом.
При взаимодействии
карбоновых кислот с натрий гидрокарбонатом
происходит выделение карбон(IY)
оксида:
В пробирку наливают 1 - 1,5 мл
насыщенного раствора натрий гидрокарбоната
и добавляют 0,1 - 0,2 мл водно-спиртового
раствора исследуемого вещества. Выделение
пузырьков карбон(IY)
оксида указывает на наличие кислоты.
RCOOH + NaHCO 3 → RCOONa + CO 2 + H 2 O
7. Качественные реакции аминов. Амины растворяются в кислотах. Многие амины (особенно алифатического ряда) обладают характерным запахом (селедочный, аммиачный и др.). Основность аминов. Алифатические амины как сильные основания способны изменять окраску таких индикаторов, как красный лакмус, фенолфталеин, универсальная индикаторная бумага. Каплю водного раствора исследуемого вещества наносят на индикаторную бумажку (лакмус, фенолфталеин, универсальная индикаторная бумага). Изменение окраски индикатора свидетельствует о присутствии аминов. В зависимости от строения амина основность его меняется в большом диапазоне. Поэтому лучше использовать универсальную индикаторную бумагу. 8. Качественные реакции полифункциональных соединений. Для качественного обнаружения бифункциональных соединений (углеводы, аминокислоты) используйте комплекс вышеописанных реакций.
Физические и термодинамические свойства
При нормальных условиях муравьиная кислота представляет собой бесцветную жидкость. Растворима в ацетоне , бензоле , глицерине , толуоле . Смешивается с водой , диэтиловым эфиром , этанолом .
| Давление паров | 120 (при 50 °C) |
| Стандартная энтальпия образования ΔH | −409,19 кДж/моль (ж) (при 298 К) |
| Стандартная энергия Гиббса образования G | −346 кДж/моль (ж) (при 298 К) |
| Стандартная энтропия образования S | 128,95 Дж/моль·K (ж) (при 298 К) |
| Стандартная мольная теплоёмкость C p | 98,74 Дж/моль·K (ж) (при 298 К) |
| Энтальпия плавления ΔH пл | 12,72 кДж/моль |
| Энтальпия кипения ΔH кип | 22,24 кДж/моль |
| Теплота сгорания -ΔH° 298 (конечные вещества CO 2 , H 2 O) | 254,58 кДж/моль |
| Число молей H 2 O на 1 моль HCOOH | m, моль HCOOH на 1 кг H 2 O | -ΔH m , кДж/моль |
|---|---|---|
| 1 | 55,51 | 0,83 |
| 2 | 27,75 | 0,87 |
| 3 | 18,50 | 0,79 |
| 4 | 13,88 | 0,71 |
| 5 | 11,10 | 0,67 |
| 6 | 9,25 | 0,62 |
| 8 | 6,94 | 0,58 |
| 10 | 5,55 | 0,56 |
| 15 | 3,70 | 0,55 |
| 20 | 2,78 | 0,55 |
| 30 | 1,85 | 0,56 |
| 40 | 1,39 | 0,57 |
| 50 | 1,11 | 0,60 |
| 75 | 0,740 | 0,65 |
| 100 | 0,555 | 0,66 |
| ∞ | 0,0000 | 0,71 |
Получение
Безопасность
Муравьиная кислота быстро перерабатывается и выводится организмом. Тем не менее, муравьиная кислота и формальдегид, образующиеся при отравлении метанолом, вызывают повреждение зрительного нерва и ведут к слепоте .
Химические свойства
HCOOH →(t) CO + H 2 O Муравьиная кислота реагирует с аммиачным раствором оксида серебра HCOOH + 2OH --> 2Ag + (NH4)2CO3 + 2NH3 + H2O Взаимодействие муравьиной кислоты с гидроксидом натрия. HCOOH+ NaOH =HCOONa+H2OНахождение в природе
В природе муравьиная кислота обнаружена в хвое , крапиве , фруктах , едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв , чем и объясняется её название .
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты . Муравьиную кислоту получают также гидролизом формамида (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола , взаимодействие метилформиата с безводным NH 3 и последующий гидролиз образовавшегося формамида 75%-ной H 2 SO 4 . Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H 2 SO 4), дегидрогенизацию СН 3 ОН в паровой фазе в присутствии катализаторов , содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Применение
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты , либо пропуская муравьиную кислоту над оксидом фосфора P 2 O 5 , для получения монооксида углерода . Схема реакции:
HCOOH → (t, H 2 SO 4) H 2 O + CO
В медицине используется для приготовления растворов пермуравьиной кислоты («первомур», или рецептура «С-4»(смесь перекиси водорода и муравьиной кислоты)). Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования .
Производные муравьиной кислоты
Соли и эфиры муравьиной кислоты называют формиатами .
См. также
Напишите отзыв о статье "Муравьиная кислота"
Примечания
|
||||||||||||||||||||||||||
Отрывок, характеризующий Муравьиная кислота
– Вы к хозяевам пойдите: они вас звали, – прибавил Борис.Берг надел чистейший, без пятнушка и соринки, сюртучок, взбил перед зеркалом височки кверху, как носил Александр Павлович, и, убедившись по взгляду Ростова, что его сюртучок был замечен, с приятной улыбкой вышел из комнаты.
– Ах, какая я скотина, однако! – проговорил Ростов, читая письмо.
– А что?
– Ах, какая я свинья, однако, что я ни разу не писал и так напугал их. Ах, какая я свинья, – повторил он, вдруг покраснев. – Что же, пошли за вином Гаврилу! Ну, ладно, хватим! – сказал он…
В письмах родных было вложено еще рекомендательное письмо к князю Багратиону, которое, по совету Анны Михайловны, через знакомых достала старая графиня и посылала сыну, прося его снести по назначению и им воспользоваться.
– Вот глупости! Очень мне нужно, – сказал Ростов, бросая письмо под стол.
– Зачем ты это бросил? – спросил Борис.
– Письмо какое то рекомендательное, чорта ли мне в письме!
– Как чорта ли в письме? – поднимая и читая надпись, сказал Борис. – Письмо это очень нужное для тебя.
– Мне ничего не нужно, и я в адъютанты ни к кому не пойду.
– Отчего же? – спросил Борис.
– Лакейская должность!
– Ты всё такой же мечтатель, я вижу, – покачивая головой, сказал Борис.
– А ты всё такой же дипломат. Ну, да не в том дело… Ну, ты что? – спросил Ростов.
– Да вот, как видишь. До сих пор всё хорошо; но признаюсь, желал бы я очень попасть в адъютанты, а не оставаться во фронте.
– Зачем?
– Затем, что, уже раз пойдя по карьере военной службы, надо стараться делать, коль возможно, блестящую карьеру.
– Да, вот как! – сказал Ростов, видимо думая о другом.
Он пристально и вопросительно смотрел в глаза своему другу, видимо тщетно отыскивая разрешение какого то вопроса.
Старик Гаврило принес вино.
– Не послать ли теперь за Альфонс Карлычем? – сказал Борис. – Он выпьет с тобою, а я не могу.
– Пошли, пошли! Ну, что эта немчура? – сказал Ростов с презрительной улыбкой.
– Он очень, очень хороший, честный и приятный человек, – сказал Борис.
Ростов пристально еще раз посмотрел в глаза Борису и вздохнул. Берг вернулся, и за бутылкой вина разговор между тремя офицерами оживился. Гвардейцы рассказывали Ростову о своем походе, о том, как их чествовали в России, Польше и за границей. Рассказывали о словах и поступках их командира, великого князя, анекдоты о его доброте и вспыльчивости. Берг, как и обыкновенно, молчал, когда дело касалось не лично его, но по случаю анекдотов о вспыльчивости великого князя с наслаждением рассказал, как в Галиции ему удалось говорить с великим князем, когда он объезжал полки и гневался за неправильность движения. С приятной улыбкой на лице он рассказал, как великий князь, очень разгневанный, подъехав к нему, закричал: «Арнауты!» (Арнауты – была любимая поговорка цесаревича, когда он был в гневе) и потребовал ротного командира.
– Поверите ли, граф, я ничего не испугался, потому что я знал, что я прав. Я, знаете, граф, не хвалясь, могу сказать, что я приказы по полку наизусть знаю и устав тоже знаю, как Отче наш на небесех. Поэтому, граф, у меня по роте упущений не бывает. Вот моя совесть и спокойна. Я явился. (Берг привстал и представил в лицах, как он с рукой к козырьку явился. Действительно, трудно было изобразить в лице более почтительности и самодовольства.) Уж он меня пушил, как это говорится, пушил, пушил; пушил не на живот, а на смерть, как говорится; и «Арнауты», и черти, и в Сибирь, – говорил Берг, проницательно улыбаясь. – Я знаю, что я прав, и потому молчу: не так ли, граф? «Что, ты немой, что ли?» он закричал. Я всё молчу. Что ж вы думаете, граф? На другой день и в приказе не было: вот что значит не потеряться. Так то, граф, – говорил Берг, закуривая трубку и пуская колечки.
– Да, это славно, – улыбаясь, сказал Ростов.
Но Борис, заметив, что Ростов сбирался посмеяться над Бергом, искусно отклонил разговор. Он попросил Ростова рассказать о том, как и где он получил рану. Ростову это было приятно, и он начал рассказывать, во время рассказа всё более и более одушевляясь. Он рассказал им свое Шенграбенское дело совершенно так, как обыкновенно рассказывают про сражения участвовавшие в них, то есть так, как им хотелось бы, чтобы оно было, так, как они слыхали от других рассказчиков, так, как красивее было рассказывать, но совершенно не так, как оно было. Ростов был правдивый молодой человек, он ни за что умышленно не сказал бы неправды. Он начал рассказывать с намерением рассказать всё, как оно точно было, но незаметно, невольно и неизбежно для себя перешел в неправду. Ежели бы он рассказал правду этим слушателям, которые, как и он сам, слышали уже множество раз рассказы об атаках и составили себе определенное понятие о том, что такое была атака, и ожидали точно такого же рассказа, – или бы они не поверили ему, или, что еще хуже, подумали бы, что Ростов был сам виноват в том, что с ним не случилось того, что случается обыкновенно с рассказчиками кавалерийских атак. Не мог он им рассказать так просто, что поехали все рысью, он упал с лошади, свихнул руку и изо всех сил побежал в лес от француза. Кроме того, для того чтобы рассказать всё, как было, надо было сделать усилие над собой, чтобы рассказать только то, что было. Рассказать правду очень трудно; и молодые люди редко на это способны. Они ждали рассказа о том, как горел он весь в огне, сам себя не помня, как буря, налетал на каре; как врубался в него, рубил направо и налево; как сабля отведала мяса, и как он падал в изнеможении, и тому подобное. И он рассказал им всё это.
В середине его рассказа, в то время как он говорил: «ты не можешь представить, какое странное чувство бешенства испытываешь во время атаки», в комнату вошел князь Андрей Болконский, которого ждал Борис. Князь Андрей, любивший покровительственные отношения к молодым людям, польщенный тем, что к нему обращались за протекцией, и хорошо расположенный к Борису, который умел ему понравиться накануне, желал исполнить желание молодого человека. Присланный с бумагами от Кутузова к цесаревичу, он зашел к молодому человеку, надеясь застать его одного. Войдя в комнату и увидав рассказывающего военные похождения армейского гусара (сорт людей, которых терпеть не мог князь Андрей), он ласково улыбнулся Борису, поморщился, прищурился на Ростова и, слегка поклонившись, устало и лениво сел на диван. Ему неприятно было, что он попал в дурное общество. Ростов вспыхнул, поняв это. Но это было ему всё равно: это был чужой человек. Но, взглянув на Бориса, он увидал, что и ему как будто стыдно за армейского гусара. Несмотря на неприятный насмешливый тон князя Андрея, несмотря на общее презрение, которое с своей армейской боевой точки зрения имел Ростов ко всем этим штабным адъютантикам, к которым, очевидно, причислялся и вошедший, Ростов почувствовал себя сконфуженным, покраснел и замолчал. Борис спросил, какие новости в штабе, и что, без нескромности, слышно о наших предположениях?
– Вероятно, пойдут вперед, – видимо, не желая при посторонних говорить более, отвечал Болконский.
Берг воспользовался случаем спросить с особенною учтивостию, будут ли выдавать теперь, как слышно было, удвоенное фуражное армейским ротным командирам? На это князь Андрей с улыбкой отвечал, что он не может судить о столь важных государственных распоряжениях, и Берг радостно рассмеялся.
– Об вашем деле, – обратился князь Андрей опять к Борису, – мы поговорим после, и он оглянулся на Ростова. – Вы приходите ко мне после смотра, мы всё сделаем, что можно будет.
И, оглянув комнату, он обратился к Ростову, которого положение детского непреодолимого конфуза, переходящего в озлобление, он и не удостоивал заметить, и сказал:
– Вы, кажется, про Шенграбенское дело рассказывали? Вы были там?
– Я был там, – с озлоблением сказал Ростов, как будто бы этим желая оскорбить адъютанта.
Болконский заметил состояние гусара, и оно ему показалось забавно. Он слегка презрительно улыбнулся.
– Да! много теперь рассказов про это дело!
– Да, рассказов, – громко заговорил Ростов, вдруг сделавшимися бешеными глазами глядя то на Бориса, то на Болконского, – да, рассказов много, но наши рассказы – рассказы тех, которые были в самом огне неприятеля, наши рассказы имеют вес, а не рассказы тех штабных молодчиков, которые получают награды, ничего не делая.
– К которым, вы предполагаете, что я принадлежу? – спокойно и особенно приятно улыбаясь, проговорил князь Андрей.
Странное чувство озлобления и вместе с тем уважения к спокойствию этой фигуры соединялось в это время в душе Ростова.
– Я говорю не про вас, – сказал он, – я вас не знаю и, признаюсь, не желаю знать. Я говорю вообще про штабных.
– А я вам вот что скажу, – с спокойною властию в голосе перебил его князь Андрей. – Вы хотите оскорбить меня, и я готов согласиться с вами, что это очень легко сделать, ежели вы не будете иметь достаточного уважения к самому себе; но согласитесь, что и время и место весьма дурно для этого выбраны. На днях всем нам придется быть на большой, более серьезной дуэли, а кроме того, Друбецкой, который говорит, что он ваш старый приятель, нисколько не виноват в том, что моя физиономия имела несчастие вам не понравиться. Впрочем, – сказал он, вставая, – вы знаете мою фамилию и знаете, где найти меня; но не забудьте, – прибавил он, – что я не считаю нисколько ни себя, ни вас оскорбленным, и мой совет, как человека старше вас, оставить это дело без последствий. Так в пятницу, после смотра, я жду вас, Друбецкой; до свидания, – заключил князь Андрей и вышел, поклонившись обоим.
Ростов вспомнил то, что ему надо было ответить, только тогда, когда он уже вышел. И еще более был он сердит за то, что забыл сказать это. Ростов сейчас же велел подать свою лошадь и, сухо простившись с Борисом, поехал к себе. Ехать ли ему завтра в главную квартиру и вызвать этого ломающегося адъютанта или, в самом деле, оставить это дело так? был вопрос, который мучил его всю дорогу. То он с злобой думал о том, с каким бы удовольствием он увидал испуг этого маленького, слабого и гордого человечка под его пистолетом, то он с удивлением чувствовал, что из всех людей, которых он знал, никого бы он столько не желал иметь своим другом, как этого ненавидимого им адъютантика.
На другой день свидания Бориса с Ростовым был смотр австрийских и русских войск, как свежих, пришедших из России, так и тех, которые вернулись из похода с Кутузовым. Оба императора, русский с наследником цесаревичем и австрийский с эрцгерцогом, делали этот смотр союзной 80 титысячной армии.
С раннего утра начали двигаться щегольски вычищенные и убранные войска, выстраиваясь на поле перед крепостью. То двигались тысячи ног и штыков с развевавшимися знаменами и по команде офицеров останавливались, заворачивались и строились в интервалах, обходя другие такие же массы пехоты в других мундирах; то мерным топотом и бряцанием звучала нарядная кавалерия в синих, красных, зеленых шитых мундирах с расшитыми музыкантами впереди, на вороных, рыжих, серых лошадях; то, растягиваясь с своим медным звуком подрагивающих на лафетах, вычищенных, блестящих пушек и с своим запахом пальников, ползла между пехотой и кавалерией артиллерия и расставлялась на назначенных местах. Не только генералы в полной парадной форме, с перетянутыми донельзя толстыми и тонкими талиями и красневшими, подпертыми воротниками, шеями, в шарфах и всех орденах; не только припомаженные, расфранченные офицеры, но каждый солдат, – с свежим, вымытым и выбритым лицом и до последней возможности блеска вычищенной аммуницией, каждая лошадь, выхоленная так, что, как атлас, светилась на ней шерсть и волосок к волоску лежала примоченная гривка, – все чувствовали, что совершается что то нешуточное, значительное и торжественное. Каждый генерал и солдат чувствовали свое ничтожество, сознавая себя песчинкой в этом море людей, и вместе чувствовали свое могущество, сознавая себя частью этого огромного целого.
Метановая к-та .
Химические свойства
Химическая формула муравьиной кислоты: HCOOH . Это один из первых представителей одноосновных карбоновых к-т. Вещество впервые выделили в 1670 году из лесного (рыжего) муравья. В естественной среде содержится в яде пчел, крапивы и иголках хвойных деревьев, выделениях медуз, фруктах.
Физические свойства
Рацемическая формула метановой кислоты: CH2O2 . Вещество при нормальных условиях имеет вид бесцветной жидкости, которая хорошо растворима в , ацетоне , толуоле и бензоле . Молярная масса = 46,02 грамм на моль. Эфиры (этиловый эфир и метиловый эфир) и соли метановой к-ты получили название формиаты .
Химические свойства
По структурной формуле Муравьиной кислоты можно сделать выводы и ее химических свойствах. Муравьиная кислота способна проявлять свойства к-т и некоторые из свойств альдегидов (восстановительные реакции).
При окислении Муравьиной кислоты, например, активно выделяется углекислый газ. Вещество применяют в качестве консервирующего агента (код Е236 ). Муравьиная кислота взаимодействует с уксусной кислотой (концентрированной) и разлагается на моноксид углерода и обычную воду с выделением тепла. Химическое соединение реагирует с гидроксидом натрия . Вещество не взаимодействует с соляной кислотой, серебром, натрия сульфатом и так далее.
Получение муравьиной кислоты
Вещество образуется в виде побочного продукта при оксислении бутана и производстве уксусной к-ты . Также ее можно получить путем гидролиза формамида и метилформиата (с избытком воды); при гидратации СО в присутствии какой-либо щелочи. Качественной реакцией для обнаружения метановой кислоты может служить реакция на альгедигы . В роли окислителя может выступать аммиачный р-р оксида серебра и Си(ОН)2 . Используется реакция серебряного зеркала.
Применение муравьиной кислоты
Вещество используют в качестве антибактериального агента и консерванта при заготовке корма на длительное хранение, средство значительно замедляет процессы распада и гниения. Химическое соединение применяют в процессе покраски шерсти; в качестве инсектицида в пчеловодстве; при проведении некоторых химических реакций (выступает в роли растворителя). В пищевой промышленности средство имеет маркировку E236 . В медицине кислоту применяют в комбинации с («первомур» или пермуравьиная кислота ) в качестве антисептика , для лечения заболеваний суставов.
Фармакологическое действие
Местноанестезирующее, отвлекающее, противовоспалительное, местнораздражающее, улучшающее тканевой метаболизм.
Фармакодинамика и фармакокинетика
Метановая кислота при нанесении на поверхность эпидермиса раздражает нервные окончания кожи, мышечной ткани, активирует специфические рефлекторные реакции, стимулирует выработку нейропептидов и энкефалинов . При этом снижается болевая чувствительность и повышается проницаемость сосудов. Вещество стимулирует процессы либерации кининов и гистамина , расширяет сосуды, стимулирует иммунологические процессы.
Показания к применению
Лекарственное средство применяют для обработки инструментов и оборудования перед операцией. Вещество используют местно в составе растворов для лечения ревматических болей, периартритов , поли- и моноартритов .
Противопоказания
Средство нельзя использовать при наличии , в месте нанесения, если есть раны и ссадины на коже.
Муравьиная или метановая кислота – представитель ряда насыщенных одноосновных карбоновых соединений.
При нормальных условиях это бесцветная жидкость, растворимая в глицерине, толуоле, ацетоне, бензоле. Вступает в реакцию с диэтиловым эфиром, этанолом, водой.
Муравьиная кислота впервые выделена из рыжих лесных муравьев в 1671 году ученым Джоном Рэйем. Искусственно синтезирована только в ХІХ веке химиком Джозефом Гей-Люссаком.
Самый распространенный метод получения вещества – выделение соединения при производстве уксусной кислоты, под воздействием жидкофазного окисления бутана. Другие способы «добычи» метановой субстанции: путем разложения глицериновых эфиров щавелевой кислоты, при окислении метанола.
При больших концентрациях отравляет организм, оказывая токсическое действие, осаждает пектины, поэтому в пищевой промышленности используется как консервант в ограниченном количестве.
Общие сведения
В природе метановая кислота обнаружена в следующих продуктах:
- клубнике;
- малине;
- яблоках;
- авокадо;
- диком ямсе;
- папае;
- крапиве;
- киноа;
- китайском личи;
- драконовом фрукте (питайе).
Помимо этого, соединение содержат безалкогольные напитки, квашенные/маринованные овощи, яблочный уксус, секрет пчел, фруктовые/рыбные консервы.
По органической структуре вещество (НСООН) относится к группе жирных кислот и проявляет сильное антимикробное действие. Его опасность зависит от концентрации. На основании данных классификации Европейского союза установлено, что жидкий 10 % раствор при контакте с кожей оказывает раздражающее действие, 15 % и выше – разъедающее, а 100 % оставляет сильные химические ожоги, способен вызвать анафилактический шок.
Для усиления вкусовых качеств, увеличения срока годности консервированных продуктов, корма для скота, муравьиная кислота и ее соли используются в пищевой промышленности в качестве добавок (Е236 – Е238).
Несмотря на то, что соединение относится к группе простейших, его роль в жизнедеятельности человека нельзя недооценивать. Метановая кислота участвует в обменных процессах. В организме животных она обеспечивает синтез пуриновых оснований, метиона, нуклеиновых кислот.
Применение
Метановая кислота не относится к разряду жизненно необходимых соединений для человеческого организма. Допустимая суточная норма вещества составляет 3 миллиграмма. Хорошо усваивается печенью, при высоких концентрациях обладает мочегонным действием, выводится с экскрементами.
Муравьиная кислота – стимулятор, который активирует межклеточный матрикс, системы органов, соединительные ткани к реакциям, за счет чего организм быстро восстанавливается.
Сегодня соединение выпускается в виде спиртовых настоек 1,4%, медицинских препаратов, входит в состав гель-бальзамов, мазей.
Для устранения прыщей метановую кислоту нанесите на проблемное место, при этом, очищать кожу предварительно не рекомендуется, поскольку это приведет к излишней потере влаги. Через 10 минут после высыхания спирта 1,4 %, нанесите на лицо увлажняющий крем. Процедуру выполнять утром и вечером в течение пяти дней.
Рассмотрим подробно, какими свойствами обладает муравьиная кислота и показания к применению препарата в лечебных целях.
Медицина и метановая кислота
Органическое соединение используют как болеутоляющее, очищающее, антисептическое, противовоспалительное и бактерицидное средство.
Для наружного применения фармакологическая промышленность выпускает вещество в виде раствора: 1,4 % муравьиной кислоты в 70 % этиловом спирте. Стандартный объем флакона – 50, 100 миллилитров. Прозрачная бесцветная жидкость имеет характерный запах этанола, усиленный парами метанового соединения. Препарат относится к категории медикаментов, которые проявляют анальгезирующие и раздражающие свойства. При наружном применении муравьиная кислота оказывает отвлекающее действие, вызывает расширение сосудов, улучшает питание тканей.
Показания к применению 1,4 % раствора:
- невралгия;
- неспецифические моно- или полиартриты;
- миозит;
- артралгия;
- миалгия.
Противопоказания:
- повреждение кожных покров в месте нанесения средства;
- гиперчувствительность к соединению.
Помимо спиртового раствора, муравьиную кислоту используют для приготовления мазей.
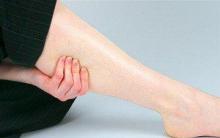
Самое распространенное средство - гель-бальзам «Муравьивит». Фармакологические свойства препарата: восстанавливающее, тонизирующие, противоотёчное, регенерирующее (обновляет ткани). Бальзам снимает воспаление, успокаивает боль, уменьшает проницаемость капилляров. Кроме того, он замедляет свертываемость крови, улучшает микроциркуляцию, повышает тонус венозных сосудов и препятствует образованию тромбоза. При местном применении уничтожает грамположительные, грамотрицательные болезненные микроорганизмы, оказывая антисептическое, обеззараживающее действие.
Показания к применению средства:
- острые приступы боли в суставах, пояснице, верхней части спины, шее;
- травмы (растяжения связок, мышц, вывихи, ушибы);
- для скорейшего заживления: царапин, ссадин, ранок, порезов, трещинок;
- обморожение конечностей, легкие термические ожоги;
- для снятия зуда от колючих растений, укуса насекомых, раздражений;
- головные боли, синяки, гематомы;
- варикозное расширение вен;
- ощущение тяжести в ногах;
- экзема, дерматиты;
- грибковые заболевания;
- угревая сыпь, фурункулы.
В народной медицине муравьиная кислота издавна применялась для лечения радикулита, подагры, ревматизма, остеопороза, педикулеза, стимуляции роста волос.
Мази, гели-бальзамы, спиртовой раствор предназначены только для наружного использования. Для облегчения состояния и снятия воспаления препарат нужно тонким слоем нанести на проблемный участок и легкими массирующими движениями плавно распределить по коже, оставить до полного высыхания. Пораженные места смазывать 2 – 3 раза в сутки до исчезновения симптомов.
Сегодня метановая кислота также применяется для производства предоперационного антисептического средства («Первомур») в хирургии для дезинфекции оборудования.
Побочные эффекты и взаимодействие с алкоголем
При обработке кожи препаратами, на основе муравьиной кислоты будьте внимательны, соблюдайте инструкцию производителя. Поскольку насыщенные растворы 10 % и выше вызывают болевую реакцию, характеризуются разъедающими свойствами. Случайный прием такого вещества внутрь поражает слизистую оболочку пищевода, желудка, способствует появлению выраженного некротического гастрита. Пары химического соединения разъедают ткани органов дыхания, вызывают ожоги роговицы глаз.
При попадании концентрированного раствора муравьиной кислоты на участок кожи немедленно обработайте место щелочным раствором (пищевой содой, бикарбонатом натрия).
Метановое соединение и его формальдегид – метаболиты, образуемые при распаде метанола в человеческом организме. Данные вещества токсичны и поражают зрительный нерв, что ведет к полной слепоте. Если в организм попал метанол, во избежание образования муравьиной кислоты под влиянием алкогольдегидрогеназы, нужно сразу выпить раствор этилового спирта. Так вы сможете не допустить протекание реакции, последствием которой является полная потеря зрения.
Этиловый спирт – своеобразный антидот, препятствующий отравлению муравьиной кислотой.
Удаление волос при помощи метановой кислоты
Соединение применяется скорее не для избавления от нежелательной растительности, а для замедления роста волос после эпиляционной процедуры. Муравьиная кислота используется как мощный антисептик, исключительно в разбавленном виде. Ее добавляют в масляную базу или приобретают сразу готовое средство. После первого нанесения на выбритый участок, масло с муравьиной кислотой увеличивает сроки между эпиляциями, продлевая результативность процедуры, затем при регулярном использовании блокирует активность фолликула. В результате волосяное волокно не образовывается, рост растительности останавливается.
Согласно отзывам девушек, использующих данный метод, «муравьиное масло» не раздражает кожу, а наоборот, делает ее шелковистой, гладкой.
Последовательность выполнения процедуры:
- удалить волосы с проблемного места (при помощи эпилятора, воска, пинцета);
- ополоснуть, просушить кожу;
- на данный участок нанести тонким слоем средство на 15 минут;
- смыть масляный состав прохладной водой;
- осмотреть участок кожи на наличие аллергической реакции, дискомфортных явлений (при появлении зуда, шероховатости, покраснения наносить масло с муравьиной кислотой категорически запрещается, если данных явлений не наблюдается процедуру можно продолжить);
- нанести повторно средство на выбранный участок еще на 15 минут, постепенно продолжительность можно увеличивать и довести до 4 часов;
- тщательно смыть масло мыльным раствором.
Данную процедуру повторяйте по мере прорастания новых волосков. Для достижения устойчивого результата запаситесь терпением, потребуется 7 – 10 эпиляций с использованием муравьиного масла. Если на коже имеются повреждения (царапины, ссадины, раны, трещинки) от процедуры следует воздержаться до их полного заживления. Помимо этого, в целях безопасности не рекомендуется наносить средство в период беременности и лактации.
Для более деликатного устранения волос 10 капель муравьиного масла нужно добавить в детский крем, полученную смесь можно ежедневно наносить на проблемные участки. Помимо замедления роста волос вы получите настоящее питательное средство.
Вывод
Муравьиная кислота – это соединение, которое благодаря лечебным, профилактическим, антибактериальным свойствам используется в разных сферах деятельности человека.
А именно: пищевой, текстильной, химической промышленностях, медицине, сельском хозяйстве, парфюмерии, косметологии, пчеловодстве. Вещество выпускается в форме спиртосодержащего раствора, мазей, бальзамов и применяется для борьбы с прыщами, нежелательной растительностью на проблемных участках, лечения невралгии, кожных заболеваний, суставов, скорейшего заживления ран, вывихов, ушибов.
Кислота отпускается без рецепта, однако ее нужно использовать с особым вниманием, соблюдая правила безопасности, поскольку при приеме внутрь она вызывает тяжелый некротический гастрит, а при попадании концентрата на кожу ̶ аллергию.
Помните, прежде, чем использовать муравьиный спирт наружно в лечебных целях, нужно предварительно нанести состав на 10 минут на проблемный участок кожи и наблюдать за обработанным место. При отсутствии аллергии препарат можно применять, соблюдая осторожность.
Физические и термодинамические свойства
При нормальных условиях муравьиная кислота представляет собой бесцветную жидкость.
| Молекулярная масса | 46,03 |
| Температура плавления | 8,25 °C |
| Температура кипения | 100,7 °C |
| Растворимость | Растворима в , |
| Плотность ρ | 1,2196 г/см³ (при 20 °C) |
| Давление паров | 120 (при 50 °C) |
| Показатель преломления | 1,3714
(температурный коэффициент показателя преломления 3,8·10 -4 , справедлив в интервале температур 10-30°C) |
| Стандартная энтальпия образования ΔH | −409,19 кДж/моль (ж) (при 298 К) |
| Стандартная энергия Гиббса образования G | −346 кДж/моль (ж) (при 298 К) |
| Стандартная энтропия образования S | 128,95 Дж/моль·K (ж) (при 298 К) |
| Стандартная мольная C p | 98,74 Дж/моль·K (ж) (при 298 К) |
| Энтальпия плавления ΔH пл | 12,72 кДж/моль |
| Энтальпия кипения ΔH кип | 22,24 кДж/моль |
| Теплота сгорания -ΔH° 298 (конечные вещества CO 2 , H 2 O) | 254,58 кДж/моль |
| Число молей H 2 O на 1 моль HCOOH | m, моль HCOOH на 1 кг H 2 O | -ΔH m , кДж/моль |
|---|---|---|
| 1 | 55,51 | 0,83 |
| 2 | 27,75 | 0,87 |
| 3 | 18,50 | 0,79 |
| 4 | 13,88 | 0,71 |
| 5 | 11,10 | 0,67 |
| 6 | 9,25 | 0,62 |
| 8 | 6,94 | 0,58 |
| 10 | 5,55 | 0,56 |
| 15 | 3,70 | 0,55 |
| 20 | 2,78 | 0,55 |
| 30 | 1,85 | 0,56 |
| 40 | 1,39 | 0,57 |
| 50 | 1,11 | 0,60 |
| 75 | 0,740 | 0,65 |
| 100 | 0,555 | 0,66 |
| ∞ | 0,0000 | 0,71 |
Получение
1. Как побочный продукт в производстве жидкофазным окислением .
Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6-0,8 МПа пропускают через нагретый до 120-130°C гидроскид натрия; на второй стадии проводят обработку формиата натрия и вакуумную перегонку продукта.
Безопасность
Муравьиная кислота - самая опасная из жирных кислот! В отличие от неорганических кислот вроде серной, легко проникает через жировой слой кожи, промывание поражённого участка раствором соды необходимо произвести немедленно!
Муравьиная кислота при попадании даже небольшого её количества на кожу причиняет очень сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Через некоторое время боль спадает. Поражённые ткани превращаются в корку толщиной до нескольких миллиметров, заживление наступает лишь через несколько недель.
Пары даже от нескольких разлитых капель муравьиной кислоты могут вызвать сильное раздражение глаз и органов дыхания.
Химические свойства
: 1,772·10 -4 .
Муравьиная кислота кроме кислотных свойств проявляет также некоторые свойства , в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO 4 + 5HCOOH + 3H 2 SO 4 → K 2 SO 4 + 2MnSO 4 + 5CO 2 + 8H 2 O
При нагревании с сильными водоотнимающимим средствами (H 2 SO 4 (конц.) или P 4 O 10) превращается в










Необычная Масленица: Цветные блины и торт из блинов с зеленым чаем
После маммопластики — что нельзя когда увеличила грудь Больно ли удалять дренаж после маммопластики
Нафтизин: инструкция по применению Можно ли нафтизин ребенку
Краткий пересказ романа Чарльза Диккенса «Приключения Оливера Твиста Краткая информация приключения оливера твиста
Академия мубинт входит в число эффективных вузов россии